sexta-feira, abril 21, 2006
Se pica sanica
 Uns dias atrás no meu piso deu-se umha situaçom que me leva a escrever sobre a auga oxigenada.
Uns dias atrás no meu piso deu-se umha situaçom que me leva a escrever sobre a auga oxigenada.
Preparando a jantar um dos meus companheiros de fatigas tivo um "cortante accidente" cumha lata de bonito (Sim, quando nom cocinho eu a dieta deriva cara o "menu do estudante") e entre muito sangue outro companheiro achegou-se ao botiquim por um desinfectante. O proto-farmaceutico pediu-lhe que colhera o bote da auga oxigenada, e cos nervos do sanguinhento percance nom parou a ler as etiquetas, a sua resposta foi: Há dous, qual de eles é? O de plastico branco ou o trasparente?
Se o meu amigo estivera mais afeito a tratar con desinfectantes ou conhecera as propriedades do Peroxido de Hidrogeno (a auga oxigenada) inmediatamente poderia reconhecer que esse produto sempre se armacena em recipientes opacos pois degrada mui rapidamente em presência de luz.
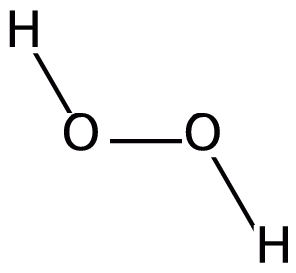
A auga oxigenada, de nome químico peroxido de oxigeno, e umha sustancia oxidante cujas moléculas contenhem dous átomos de oxigeno e dous de hidrogeno: H2O2. Sem entrar em disquisiçons químicas chega com saber que esse "oxigeno de mais" (Em realidade o radical peroxi -R-OO-R-) sobre a fórmula da auga fai aos peroxidos muito inestáveis, tende a romper a sua ligaçom oxigeno-oxigeno e formar "radicais livres" (Cona!, como nos sindicatos de estudantes :P) que decontado reagem co meio. E umha reacçom exotérmica, desprende muita energia.

Descobriu-no em 1818 o químico francês Louis Jacques Thénard ao trabalhar co peroxido de bario. Thérnard já era conhecido dende mui jovem por ter descuverto em 1799 o tingura azul cobalto que leva o seu nome e que ainda hoje emprega-se na industria da porcelana e o seu achado tivo ceda aplicaçom. Empregouse no branqueado das teas e em diferentes processos industriais. Mais a sua inestavilidade fazia dificil o seu emprego: A mais pequena traça de ions metálicos (ferro, manganeso) ou partículas orgánicas fai que o H2O2 descomponha-se em auga. Os metais actuam como catalisadores, e dizer, que propiciam as reacçons mais depois seguem actuando: Umha soa partícula de catalisador pode desbotar centos de moléculas de peroxido. A materia orgánica contem catálase, umha das enzimas mais comuns nos animais; é umha oxidoreductasa, e dizer actua em processos Redox da vida. E muito importante para os seres vivos, que producem umha quantidade considerável de peroxido de oxigeno no seu metabolismo que pode resultar mui toxico. Umha soa molécula de catálase pode desbotar 50.000 moléculas de peroxido num segundo, quando partilha com a glutatom-perosídase pode chegar às 200.000 moléculas. Esta efectividade é imprescindível, um só aniom hiper-oxido (O2-) pode fazer muito dano ao metabolismo neuronal. Uns orgánulos especiais das células, os peroxissomas, empregam as catálases para limpar alguns produtos tóxicos. Pero nom temades! A auga oxigenada é praticamente inocua nas concentraçons empregadas no fogar. Podedes fazer umha experiência na vossa cocinha para comprovar a eficiência da catálase: Colhede um copo de cristal e botade um pouco de auga oxigenada, engadide um chisco de carne crua picada (e fresca), podedes observar o que acontece, e incluso notar como aumenta a sua temperatura. Aquí tedes umha demostraçom do exotermica que pode ser a reacçom de peroxido muito concentrado com o coiro (57442 KB ).
Volvendo à historia do peroxido: No 1873 melhorouse o proceso de armacenagem e fabricaçom e escomezou a sua comercializaçom em Berlim. Porém, tinha que ser empregado em poucos dias . Em umha semana a metade do H2O2 já era auga e hidrógeno, e perdera a meirande parte das suas propriedades. Já na primeira década do século XX implementou-se um método de producçom eletroquímico, mais a sua caducidade era de umhas duas semanas. Já daquela o peroxido tinha aplicaçons higienicas e cosméticas (branqueado do cabelo e dos dentes) em concentraçons do 5%. Muitras fabricas de teas tinham ao carom umha fabrica de peroxido para branquear a lá e outros tecidos, em concentraçons do trinta per cento. Cara 1930 os tanques de aceiro inoxidavel permitiam conserva-lo quatro semanas e transporta-lo.
 O III Reich e a II Guerra Mundial disparou a demanda do H2O2. E nom como anti-séptico, se nom como material bélico. A teima alemana com bombardear Londres dende o continente levou por diante miles de vidas pero também acelerou, mal que nos pese, a aerodinámica e plantou as sementes da futura carreira espacial. Os Vergeltungswaffe ("Armas da Vingança") empregados polos nazis para sementar o terror e a morte povoarom os pesadelos do meio continente. O primerio, o V1,nom era mais que umha bomba voante, pai dos misseis, e o V2 (também Aggregat 4), antecedente dos foguetes espaciais empregava um sistema complexo de combustível líquido. Ambos precisavam de grandes quantidades de auga oxigenada, e a concentraçons superiores ao oitenta per cento.Transporta-las dende as fábricas do interior do Reich chara a costa da França obrigarom a desenhar novos métodos de fabricaçom e armacenagem. A antraquinona foi a soluçom: outro catalisador que sometido primeiro ao efeito do H2 e depois ao do O2 produze auga oxigena. O método é tam eficaz que hoje em dia é o mais extendido.
O III Reich e a II Guerra Mundial disparou a demanda do H2O2. E nom como anti-séptico, se nom como material bélico. A teima alemana com bombardear Londres dende o continente levou por diante miles de vidas pero também acelerou, mal que nos pese, a aerodinámica e plantou as sementes da futura carreira espacial. Os Vergeltungswaffe ("Armas da Vingança") empregados polos nazis para sementar o terror e a morte povoarom os pesadelos do meio continente. O primerio, o V1,nom era mais que umha bomba voante, pai dos misseis, e o V2 (também Aggregat 4), antecedente dos foguetes espaciais empregava um sistema complexo de combustível líquido. Ambos precisavam de grandes quantidades de auga oxigenada, e a concentraçons superiores ao oitenta per cento.Transporta-las dende as fábricas do interior do Reich chara a costa da França obrigarom a desenhar novos métodos de fabricaçom e armacenagem. A antraquinona foi a soluçom: outro catalisador que sometido primeiro ao efeito do H2 e depois ao do O2 produze auga oxigena. O método é tam eficaz que hoje em dia é o mais extendido.

Cara o final da Guerra umha nova geraçom de avions-foguetes que empregavam H2O2 foi investigada, mais nunca chegou a aplicar-se em bataias reais. Os Messerschmitt Me 163 (Mitsubishi J8M nas provas em Japom) ou Komet eram verdadeiros foguetes pilotados que alcazavam os 1000 Km/h.
Rematada a Guerra o peroxido empregou-se no mundo civil dum jeito menos dramático. Branqueadura de tecidos ou materiais como o marfil e a madeira e o papel, fabricaçom de plásticos e uso médico. Hoje a produçom mundial é de uns 2,3 milhons de toneladas, a metade delas empregadas na industria papeleira. À auga oxigenada de uso doméstico engeda-se-lhe estavilizantes como o Timol para que perdure mais tempo.
 Mais, Como actua a auga oxigenada na desinfecçom? Como já se dixo é um oxidante que livera radicais livres sobre os microbios. Agás o alcool e o hipoclorito há poucas cousas mais efectivas! Os radicais unem-se ás moléculas estructurais da bacteria/virus/fungo e destruem-nas por completo. Quimicamente é como se as queimásemos cum soplete . Nom tem mais segredo. O peroxido reage também coa nossa pele e sangue, mais o dano é minimo e na meirande parte dos casos é so tecido que já morrería a consequência do trauma ou o corte. Desse proceso de oxidaçom provem a sensaçom de pruido e ao H2 liverado a escuma que vemos. :)
Mais, Como actua a auga oxigenada na desinfecçom? Como já se dixo é um oxidante que livera radicais livres sobre os microbios. Agás o alcool e o hipoclorito há poucas cousas mais efectivas! Os radicais unem-se ás moléculas estructurais da bacteria/virus/fungo e destruem-nas por completo. Quimicamente é como se as queimásemos cum soplete . Nom tem mais segredo. O peroxido reage também coa nossa pele e sangue, mais o dano é minimo e na meirande parte dos casos é so tecido que já morrería a consequência do trauma ou o corte. Desse proceso de oxidaçom provem a sensaçom de pruido e ao H2 liverado a escuma que vemos. :)
Para rematar algumhas mentiras sobre a auga oxigenada:
-"Os banhos cum pouco de auga oxigenada rejuvenesce a pele": Auga corrente contem muitos minerales, retos orgánicos e reactivos. O H2O2 para emprego no fogar perde todas as suas propriedades ao se lhe engadir só um chisco de auga da bilha. Imagina mete-lo numha banheira!
-"Engadir um pouco de auga oxigenada às prantas fai que duram mais, ou que as sementes dadas prendam melhor": O mesmo que o caso anterior. E ademais nom tem sentido metabólico...
-"Ponher um pouquinho na auga das galinhas fai que os ovos saiam mais saborosos": (Esta muito extendida na Galiza) Mais do mesmo. E o metabolismo da pita fai impossível que algo do peroxido chegue aos organos que intervenhem na producçom dos ovos.
Se conhecedes algumha mais poco comprovar se é verdade ou nom.
Para mais informaçom sobre este produto (Como estamos na semana do livro todos eles por escrito):
-Vanity, Vitality, Virility ; John Emsley: Um bom livro para conhecer mais sobre os produtos químicos na nossa vida cotiá. Pero, Coidado! Emsley e mui pouco neutral e muitas veces recurre a argumentos mui estupidos numha "cruzada" contra os ecologistas.
-A Short History os Chemistry; Isaac Asimov: Tem um capitulo adicado aos peroxidos mui divulgativo.
(Nota: Os químicos que queiram dar-me um par de ostias por meter-me fora do meu campo que mandem as queixas ao meu correio ou comentem aquí :) )
(Nota2: Nom tivem tempo de revisar o texto, nom me matedes polas faltas :P)
Um beijo a todos!
 Uns dias atrás no meu piso deu-se umha situaçom que me leva a escrever sobre a auga oxigenada.
Uns dias atrás no meu piso deu-se umha situaçom que me leva a escrever sobre a auga oxigenada.Preparando a jantar um dos meus companheiros de fatigas tivo um "cortante accidente" cumha lata de bonito (Sim, quando nom cocinho eu a dieta deriva cara o "menu do estudante") e entre muito sangue outro companheiro achegou-se ao botiquim por um desinfectante. O proto-farmaceutico pediu-lhe que colhera o bote da auga oxigenada, e cos nervos do sanguinhento percance nom parou a ler as etiquetas, a sua resposta foi: Há dous, qual de eles é? O de plastico branco ou o trasparente?
Se o meu amigo estivera mais afeito a tratar con desinfectantes ou conhecera as propriedades do Peroxido de Hidrogeno (a auga oxigenada) inmediatamente poderia reconhecer que esse produto sempre se armacena em recipientes opacos pois degrada mui rapidamente em presência de luz.
A auga oxigenada, de nome químico peroxido de oxigeno, e umha sustancia oxidante cujas moléculas contenhem dous átomos de oxigeno e dous de hidrogeno: H2O2. Sem entrar em disquisiçons químicas chega com saber que esse "oxigeno de mais" (Em realidade o radical peroxi -R-OO-R-) sobre a fórmula da auga fai aos peroxidos muito inestáveis, tende a romper a sua ligaçom oxigeno-oxigeno e formar "radicais livres" (Cona!, como nos sindicatos de estudantes :P) que decontado reagem co meio. E umha reacçom exotérmica, desprende muita energia.

Descobriu-no em 1818 o químico francês Louis Jacques Thénard ao trabalhar co peroxido de bario. Thérnard já era conhecido dende mui jovem por ter descuverto em 1799 o tingura azul cobalto que leva o seu nome e que ainda hoje emprega-se na industria da porcelana e o seu achado tivo ceda aplicaçom. Empregouse no branqueado das teas e em diferentes processos industriais. Mais a sua inestavilidade fazia dificil o seu emprego: A mais pequena traça de ions metálicos (ferro, manganeso) ou partículas orgánicas fai que o H2O2 descomponha-se em auga. Os metais actuam como catalisadores, e dizer, que propiciam as reacçons mais depois seguem actuando: Umha soa partícula de catalisador pode desbotar centos de moléculas de peroxido. A materia orgánica contem catálase, umha das enzimas mais comuns nos animais; é umha oxidoreductasa, e dizer actua em processos Redox da vida. E muito importante para os seres vivos, que producem umha quantidade considerável de peroxido de oxigeno no seu metabolismo que pode resultar mui toxico. Umha soa molécula de catálase pode desbotar 50.000 moléculas de peroxido num segundo, quando partilha com a glutatom-perosídase pode chegar às 200.000 moléculas. Esta efectividade é imprescindível, um só aniom hiper-oxido (O2-) pode fazer muito dano ao metabolismo neuronal. Uns orgánulos especiais das células, os peroxissomas, empregam as catálases para limpar alguns produtos tóxicos. Pero nom temades! A auga oxigenada é praticamente inocua nas concentraçons empregadas no fogar. Podedes fazer umha experiência na vossa cocinha para comprovar a eficiência da catálase: Colhede um copo de cristal e botade um pouco de auga oxigenada, engadide um chisco de carne crua picada (e fresca), podedes observar o que acontece, e incluso notar como aumenta a sua temperatura. Aquí tedes umha demostraçom do exotermica que pode ser a reacçom de peroxido muito concentrado com o coiro (57442 KB ).
Volvendo à historia do peroxido: No 1873 melhorouse o proceso de armacenagem e fabricaçom e escomezou a sua comercializaçom em Berlim. Porém, tinha que ser empregado em poucos dias . Em umha semana a metade do H2O2 já era auga e hidrógeno, e perdera a meirande parte das suas propriedades. Já na primeira década do século XX implementou-se um método de producçom eletroquímico, mais a sua caducidade era de umhas duas semanas. Já daquela o peroxido tinha aplicaçons higienicas e cosméticas (branqueado do cabelo e dos dentes) em concentraçons do 5%. Muitras fabricas de teas tinham ao carom umha fabrica de peroxido para branquear a lá e outros tecidos, em concentraçons do trinta per cento. Cara 1930 os tanques de aceiro inoxidavel permitiam conserva-lo quatro semanas e transporta-lo.
 O III Reich e a II Guerra Mundial disparou a demanda do H2O2. E nom como anti-séptico, se nom como material bélico. A teima alemana com bombardear Londres dende o continente levou por diante miles de vidas pero também acelerou, mal que nos pese, a aerodinámica e plantou as sementes da futura carreira espacial. Os Vergeltungswaffe ("Armas da Vingança") empregados polos nazis para sementar o terror e a morte povoarom os pesadelos do meio continente. O primerio, o V1,nom era mais que umha bomba voante, pai dos misseis, e o V2 (também Aggregat 4), antecedente dos foguetes espaciais empregava um sistema complexo de combustível líquido. Ambos precisavam de grandes quantidades de auga oxigenada, e a concentraçons superiores ao oitenta per cento.Transporta-las dende as fábricas do interior do Reich chara a costa da França obrigarom a desenhar novos métodos de fabricaçom e armacenagem. A antraquinona foi a soluçom: outro catalisador que sometido primeiro ao efeito do H2 e depois ao do O2 produze auga oxigena. O método é tam eficaz que hoje em dia é o mais extendido.
O III Reich e a II Guerra Mundial disparou a demanda do H2O2. E nom como anti-séptico, se nom como material bélico. A teima alemana com bombardear Londres dende o continente levou por diante miles de vidas pero também acelerou, mal que nos pese, a aerodinámica e plantou as sementes da futura carreira espacial. Os Vergeltungswaffe ("Armas da Vingança") empregados polos nazis para sementar o terror e a morte povoarom os pesadelos do meio continente. O primerio, o V1,nom era mais que umha bomba voante, pai dos misseis, e o V2 (também Aggregat 4), antecedente dos foguetes espaciais empregava um sistema complexo de combustível líquido. Ambos precisavam de grandes quantidades de auga oxigenada, e a concentraçons superiores ao oitenta per cento.Transporta-las dende as fábricas do interior do Reich chara a costa da França obrigarom a desenhar novos métodos de fabricaçom e armacenagem. A antraquinona foi a soluçom: outro catalisador que sometido primeiro ao efeito do H2 e depois ao do O2 produze auga oxigena. O método é tam eficaz que hoje em dia é o mais extendido.
Cara o final da Guerra umha nova geraçom de avions-foguetes que empregavam H2O2 foi investigada, mais nunca chegou a aplicar-se em bataias reais. Os Messerschmitt Me 163 (Mitsubishi J8M nas provas em Japom) ou Komet eram verdadeiros foguetes pilotados que alcazavam os 1000 Km/h.
Rematada a Guerra o peroxido empregou-se no mundo civil dum jeito menos dramático. Branqueadura de tecidos ou materiais como o marfil e a madeira e o papel, fabricaçom de plásticos e uso médico. Hoje a produçom mundial é de uns 2,3 milhons de toneladas, a metade delas empregadas na industria papeleira. À auga oxigenada de uso doméstico engeda-se-lhe estavilizantes como o Timol para que perdure mais tempo.
 Mais, Como actua a auga oxigenada na desinfecçom? Como já se dixo é um oxidante que livera radicais livres sobre os microbios. Agás o alcool e o hipoclorito há poucas cousas mais efectivas! Os radicais unem-se ás moléculas estructurais da bacteria/virus/fungo e destruem-nas por completo. Quimicamente é como se as queimásemos cum soplete . Nom tem mais segredo. O peroxido reage também coa nossa pele e sangue, mais o dano é minimo e na meirande parte dos casos é so tecido que já morrería a consequência do trauma ou o corte. Desse proceso de oxidaçom provem a sensaçom de pruido e ao H2 liverado a escuma que vemos. :)
Mais, Como actua a auga oxigenada na desinfecçom? Como já se dixo é um oxidante que livera radicais livres sobre os microbios. Agás o alcool e o hipoclorito há poucas cousas mais efectivas! Os radicais unem-se ás moléculas estructurais da bacteria/virus/fungo e destruem-nas por completo. Quimicamente é como se as queimásemos cum soplete . Nom tem mais segredo. O peroxido reage também coa nossa pele e sangue, mais o dano é minimo e na meirande parte dos casos é so tecido que já morrería a consequência do trauma ou o corte. Desse proceso de oxidaçom provem a sensaçom de pruido e ao H2 liverado a escuma que vemos. :)Para rematar algumhas mentiras sobre a auga oxigenada:
-"Os banhos cum pouco de auga oxigenada rejuvenesce a pele": Auga corrente contem muitos minerales, retos orgánicos e reactivos. O H2O2 para emprego no fogar perde todas as suas propriedades ao se lhe engadir só um chisco de auga da bilha. Imagina mete-lo numha banheira!
-"Engadir um pouco de auga oxigenada às prantas fai que duram mais, ou que as sementes dadas prendam melhor": O mesmo que o caso anterior. E ademais nom tem sentido metabólico...
-"Ponher um pouquinho na auga das galinhas fai que os ovos saiam mais saborosos": (Esta muito extendida na Galiza) Mais do mesmo. E o metabolismo da pita fai impossível que algo do peroxido chegue aos organos que intervenhem na producçom dos ovos.
Se conhecedes algumha mais poco comprovar se é verdade ou nom.
Para mais informaçom sobre este produto (Como estamos na semana do livro todos eles por escrito):
-Vanity, Vitality, Virility ; John Emsley: Um bom livro para conhecer mais sobre os produtos químicos na nossa vida cotiá. Pero, Coidado! Emsley e mui pouco neutral e muitas veces recurre a argumentos mui estupidos numha "cruzada" contra os ecologistas.
-A Short History os Chemistry; Isaac Asimov: Tem um capitulo adicado aos peroxidos mui divulgativo.
(Nota: Os químicos que queiram dar-me um par de ostias por meter-me fora do meu campo que mandem as queixas ao meu correio ou comentem aquí :) )
(Nota2: Nom tivem tempo de revisar o texto, nom me matedes polas faltas :P)
Um beijo a todos!
Comments:
<< Home
Sim,sim! Nom é raro topa-lo como oxidante hoje em dia em armas nos paises do 3º mundo (refugalhos da Guerra Fria). Mais nom sabia o do Kursk! Obrigado!
Isso é verdade. O contido activo de muitos branqueadores é o peroxido de urea (sim, urea, como nos ourinhos), umha combinhaçom de urea e peróxido ligados por pontes de hidrogeno.
Ao entrar em contacto coas enzimas da boca o H2O2 libéra-se e perfunde o esmalte, ate chegar à dentina, onde branquea o tecido.
:)
Enviar um comentário
Ao entrar em contacto coas enzimas da boca o H2O2 libéra-se e perfunde o esmalte, ate chegar à dentina, onde branquea o tecido.
:)
<< Home




















